金纳米粒子(AuNPs)具有独特的物理化学性质,包括光学效应、介电特性以及突出的生物相容性等特征,已被应用于医学检测、生物催化、新型药物载体、环境保护、寡核苷酸芯片等领域。纳米金为分散相溶胶,粒子表面包覆着带负电的离子,电荷之间的相互排斥作用使金纳米粒子可以在水中维持着比较稳定的悬浮状态,同时吸附水中的H+,从而形成稳定的胶体。金纳米粒子的制备已有较多文献报道,目前常用的有物理法和化学法,其中物理法包括激光烧灼、研磨粉碎等,而化学法有种子生长法、柠檬酸钠还原法等。尽管这些制备方法比较成熟,但仍然存在着过程复杂、条件苛刻、化学还原剂用量大等问题。
近年来,已有许多研究者利用生物法制备出纳米金粒子,陶晶利用芦荟提取物制备出粒径在20~50nm的金纳米粒子,Rajasree等利用革兰氏阴性菌荧光假单胞菌合成粒径在50~70nm之间的纳米金粒子。某些微生物酶或植物蛋白可作为还原剂应用于金纳米粒子的绿色合成,制备获得的金纳米粒子有更好的生物相容性,制备过程也较为温和。角蛋白酶是一种特殊的同时拥有肽键水解和二硫键还原特性的多功能蛋白酶类,能将硬质不溶性角蛋白(如羽毛、羊毛等)转化为可溶蛋白、氨基酸及多肽。微生物角蛋白酶来源广泛,相比其他还原性功能的生物酶使用简单,具有更广泛的应用价值。本研究首次探索了微生角蛋白酶制备金纳米粒子的方法。
枯草芽孢杆菌WB600是本研究室构建的高表达角蛋白酶基因的一株工程菌,其分泌的角蛋白酶具有较强的还原力。本文利用该角蛋白酶制备金纳米粒子,主要研究了加酶量、反应时间和氯金酸浓度对纳米金颗粒的影响,通过电感耦合等离子体质谱仪(ICP-MS)对反应过程进行监(测,然后通过透射电镜(TEM)、动态光散射DLS)、傅里叶红外光谱(FTIR)等方法对金纳米粒子进行了表征。
1 实验材料和方法
1.1 材料
1.1.1 菌株
枯草芽孢杆菌WB600(PMA5-aprE-kerBv),为本实验前期构建所得[18]。1.1.2主要试剂
氯金酸、琼脂粉、甘油、磷酸氢二钾、磷酸二氢钾、氯化钠、脱脂奶粉购于国药集团化学试剂有限公司;酵母粉、蛋白胨(生化试剂)购于OXOID公司;可溶性角蛋白购于TCI公司。1.1.3培养基LB液体培养基:蛋白胨10g/L,酵母粉5g/L,氯化钠10g/L。TB液体培养基:酵母粉28g/L,蛋白胨14g/L,甘油20g/L,磷酸氢二钾16.4g/L,磷酸二氢钾2.3g/L。牛奶固体LB培养基:蛋白胨10g/L,酵母粉5g/L,脱脂奶粉10g/L,氯化钠10g/L,琼脂粉15g/L。
1.2 角蛋白酶的制备
将枯草芽孢杆菌WB600划线接种在牛奶固体琼脂培养基上,在37℃恒温培养箱培养12h后,选择平板上透明圈较大且生长较快的单菌落,转接至LB液体培养基中。在37℃、220r/min的恒温回旋式摇床中培养12h作为种子液,以5%接种量接种至TB液体培养基,在37℃、220r/min的回旋式摇床中发酵产酶。最后将发酵液在7500r/min、4℃条件下离心20min,获得的上清液用孔径为0.22μm的微孔滤膜过滤除菌,测定角蛋白酶活性及其还原力,低温储存备用。1.3金纳米粒子的制备及条件优化称取适量的氯金酸粉末,室温下溶于超纯水中,用0.22μm微孔滤膜过滤除菌。根据实验设计,量取50mL氯金酸溶液加入250mL的锥形瓶中,加入一定量的角蛋白酶;用锡纸包裹锥形瓶,在摇床中以37℃、100r/min的条件振荡反应一定时间并取样进行紫外-可见分光光度(UV-vis)光谱扫描。制备过程通过控制合成反应中的三个因素进行逐步优化,分别为氯金酸浓度(0.5mmol/L、1mmol/L、1.5mmol/L、2mmol/L、2.5mmol/L、5mmol/L)、酶添加量(700U、875U、1050U、1225U、1400U、1575U、1750U)以及合成反应时间(1h、3h、5h、7h等)。
2 实验结果与讨论
2.1金纳米粒子的制备
角蛋白酶kerBv表现出较强的还原性能,对羽毛的高水解活性也源于对二硫键的还原作用,能将溶液中的金属离子还原为金属单质。为充分挖掘该酶的应用潜力,本实验采用角蛋白酶为还原剂进行金纳米粒子的制备,在实验过程中,通过控制氯金酸浓度、酶液添加量和反应时间三个因素逐步进行合成反应优化。由于金纳米粒子的表面存在等离子共振,在不同的波长下有不同的吸收值,所以本研究采用UV-vis光谱扫描检测金纳米粒子的形成。
2.1.1角蛋白酶量对金纳米粒子的影响
分别对不同加酶量所制备的纳米金样品进行UV-vis光谱扫描。在反应进行4h后,含有700U角蛋白酶的体系无明显共振峰峰值出现。随着加酶量的增大,反应体系在550nm处出现明显的共振峰,而且共振峰的大小先随着加酶量的增加而增大,在加酶量为1400U时达到了最大值0.65。然而,在加酶量为1575U、1750U时峰值下降,分别为0.60和0.52。推测是由于体系中加酶量太高,反应速率过快导致生成的金纳米粒子迅速沉降。所以本研究选择了1400U为最适加酶量,并用于下一步实验。
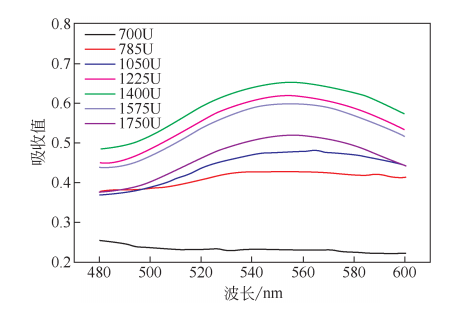
2.1.2氯金酸浓度对金纳米粒子的影响
在酶法制备纳米金的过程中,角蛋白酶起还原剂的作用,而氯金酸就是金单质的前体物质。纳米金共振峰随着氯金酸浓度变化图。当浓度为1mmol/L时,反应体系的峰强最强,峰值为0.81。当浓度为1.5mmol/L、2mmol/L、2.5mmol/L时,峰值分别为0.74、0.44和0.56,均小于1mmol/L时的峰值。由此可知,当氯金酸浓度为1mmol/L时,金纳米颗粒的产率最高。后续研究选择1mmol/L氯金酸和1400U角蛋白酶研究反应时间的影响。
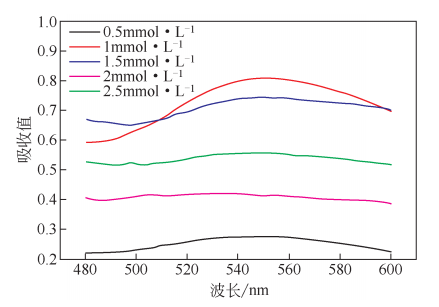
2.1.3反应时间对金纳米粒子的影响
反应时间是影响反应进行程度的一个因素。分别对不同反应时间所制备的金纳米粒子样品进行UV-vis光谱扫描。反应2h时,体系中没有检测到由金纳米粒子产生的共振峰峰值。随着反应时间的延长,共振峰峰值增大。当反应进行5h后,反应体系的峰值达到最大值0.93。而在6h时,峰值下降,说明体系中纳米金颗粒变少,推测是由于反应时间过长,已经产生的纳米粒子形成了团聚。最终,本研究以1mmol/L氯金酸溶液、1400U角蛋白酶反应5h为制备金纳米粒子的最优条件。此外,各体系共振峰位置随反应的进行并未发生移动,表明角蛋白酶能够合成稳定性良好的金纳米粒子。
2.2金纳米粒子的形貌表征
采用优化条件进行金纳米粒子制备,通过透射电镜对金纳米粒子的形态进行观察。大部分粒子的形状为球形,分散在溶液中,没有发生聚集现象。对视野范围内的粒子进行测定,可知粒径均在30nm以下,粒子之间间距比较明显,没有聚集。但是金纳米粒子粒径仍不够均匀,推测是由于在将角蛋白酶液滴入氯金酸溶液的一瞬间,局部的角蛋白酶浓度较高,导致金单质的生成速度过快,迅速凝聚成粒径为30nm的较大纳米粒子。而在将体系混匀之后,反应速度下降,所以制备出的金纳米粒子粒径较小。
2.3金纳米粒子红外吸收光谱
用傅里叶变换红外光谱(FTIR)对金纳米粒子进行表征。波长介于3100~3500cm-1之间的吸收带是酰胺N—H键的不对称伸缩振动峰,1452cm-1处的吸收带归因于氨基酸残基—COO—基团的对称伸缩振动,而1650cm-1处的吸收带则代表的是酰胺Ⅰ带。可以初步推断,角蛋白酶本身参与了金纳米粒子的合成,并成为维系粒子稳定的关键物质。
2.4金纳米粒子的粒径分布检测
动态光散射的结果,实验所得金纳米粒子的粒径大部分分布在75nm左右,zeta电位值为-13mV,表明其胶体的稳定性主要来源于负电荷之间的静电排斥。由于透射电镜(TEM)是在粒子干燥的状态下拍摄的,所得的粒径是粒子的真实粒径。动态光散射(DLS)测量的是粒子在溶液状态下的水合粒径,包括粒子的核以及膨胀的胶团。所以DLS测得的粒径会高于其真实值,这一现象在其他研究中也有报道。
3 结论
本实验采用角蛋白酶法所得金纳米粒子的粒径在30nm以下,PDI指数为0.29,zeta电位为-13mV,在550nm左右有明显吸收峰。该实验证明有活性的角蛋白酶有助于金纳米粒子的生成,并且所得金纳米粒子粒径较小,制备时间较短。该方法具有的良好的稳定性和可操作性,为金纳米粒子绿色化制备提供了一种新途径。但是目前制备出的金纳米粒子粒径分布较宽,样品尺度均一性仍有待进一步改进,后续可进行制备条件的进一步优化。
AWSG爱保信(Biotech)投行事业部,由深耕生物医药领域多年的资深投行专家以及来自国内外顶尖院校的生物医药专业博士组成,致力于帮助全球最好的生物技术产业化和资本化,以资本、人才、技术资源助力,全链条全周期地陪伴生物医药公司共同生长,成为生物医药公司背后最坚定的助跑者。
